iPS細胞は、再生医療や創薬の分野で革新的な可能性を秘めた日本発の技術として、世界中から注目を集めています。体の一部の細胞を初期化し、さまざまな組織や臓器へと変化できる特性を持つことから、心臓病や脊髄損傷、視覚障害など従来は治療が難しかった病気に新しい道を開きつつあります。
一方で、安全性やコスト、倫理的な課題も残されており、課題克服の取り組みが進められています。本記事では、iPS細胞の基礎から実用化の現状、大阪・関西万博での展示や未来の展望までを分かりやすく整理し、医療や社会との関わりを総合的に解説します。
iPS細胞とは?
iPS細胞は再生医療や創薬など、未来の医療を大きく変える可能性を秘めた細胞です。その特徴を見てみましょう。
iPS細胞の基本的な特徴と構造
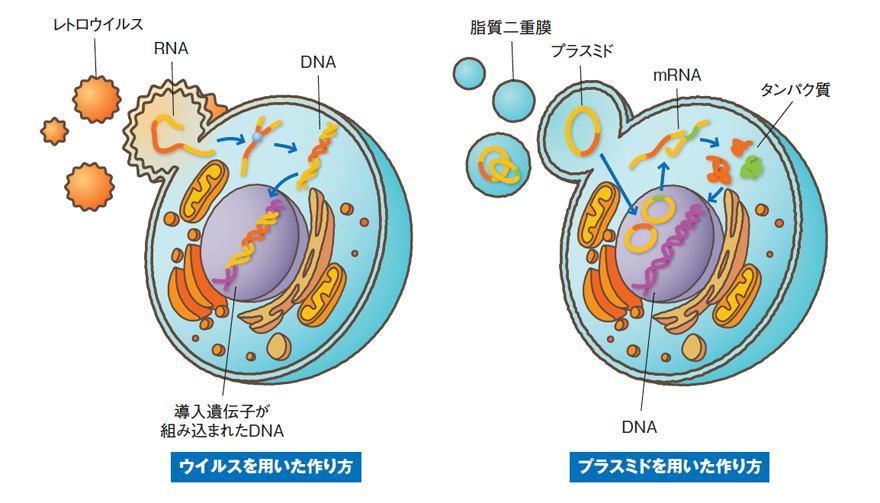
iPS細胞(人工多能性幹細胞)は、皮膚や血液など体の一部の細胞に特定の遺伝子を導入して作られる細胞です。最大の特徴は「ほぼ無限に増やせる」ことと「体のあらゆる組織に変化できる」ことにあります。これを専門的に言うと「自己複製性」と「多能性」という性質です。自己複製性とは、細胞自身が同じ細胞を繰り返し作り続けられる能力のこと。つまり、少しの数からでも大量に増やすことが可能です。多能性とは、心臓・神経・血液・皮膚など、多様な細胞へ変化できる性質を指します。
さらに「未分化性」と呼ばれる特徴も大切です。未分化性とは、まだ特定の細胞に決まっていない“赤ちゃんのような細胞”であることを意味し、そこから必要に応じて分化(専門の細胞になること)が可能になるのです。
こうした性質があるからこそ、iPS細胞は再生医療や新薬開発に強く期待されており、「第二の臓器をつくる」技術の基盤とされています。
ES細胞・体細胞・幹細胞との違い
iPS細胞を正しく理解するためには、ES細胞(胚性幹細胞)、体細胞、そして幹細胞との違いを整理することが重要です。ES細胞は受精卵から作られるため、多能性が高くあらゆる細胞に分化できますが、ヒトの胚を用いる点で強い倫理的問題が指摘されてきました。
一方、体細胞はすでに役割が決まった細胞で、皮膚や血液のように心臓や神経などに変化することはできません。幹細胞は体内に存在する特殊な細胞で、一部は分化能力を持ち再生医療にも応用可能ですが、種類や能力に限界があります。
そこで登場したのがiPS細胞です。これは体細胞を人工的に初期化することでES細胞に近い多能性を獲得したもので、倫理的ハードルを大きく下げたことが画期的とされています。
| 種類 | 作られる方法・由来 | 特徴(多能性・自己複製性など) | 倫理的課題 | 医療応用の範囲 |
|---|---|---|---|---|
| iPS細胞 | 体細胞に特定の遺伝子を導入して人工的に初期化 | 多能性あり・自己複製可能・未分化性を保持 | 低い(受精卵を使用しないため) | 再生医療(心筋シート・網膜など)、創薬研究、病態モデル |
| ES細胞 | 受精卵(胚)から採取 | 多能性あり・自己複製可能 | 高い(生命倫理問題) | 研究用途中心、一部基礎医療研究 |
| 体細胞 | 皮膚や血液など、体内の役割が決まった細胞 | 多能性なし・自己複製性ほぼなし | なし | 限定的(移植や細胞治療の一部で利用) |
| 幹細胞 | 骨髄や脂肪などに存在する、未分化の特殊な細胞 | 限定的な多能性あり(例:血球系・神経系) | 低い | 再生医療の一部に応用(骨髄移植など) |
医療現場ではES細胞は実験段階に制限が多いのに対し、iPS細胞は既に心筋シートや網膜再生などの臨床応用に進んでいます。この「倫理性」と「実用化への可能性」の両立こそが、iPS細胞の大きな強みなのです。
iPS細胞誕生の歴史〜山中教授によるマウス実験が始まり〜
iPS細胞の誕生は2006年、山中伸弥教授によるマウス実験から始まりました。この研究により、体細胞を初期化して「多能性」を持たせられることが示され、世界の医療研究に革命をもたらしました。2012年にはその功績が評価され、ノーベル生理学・医学賞を受賞しています。この発見の意義は大きく二つあります。
第一に、ES細胞が抱えていた「受精卵を用いることによる倫理的問題」を回避できた点です。体細胞から作るiPS細胞は倫理的な受容性が高く、社会的合意を得やすいものでした。第二に、医療応用の可能性の拡大です。例えば、心筋シートを使った心臓治療や網膜再生研究など、治療に直結する臨床応用が次々と進展しました。
山中教授の発見は「生命倫理」と「医療実用化」の両立を実現した画期的成果であり、再生医療の未来を大きく切り拓いた出来事といえます。
iPS細胞が切り開く医療の未来とメリット
iPS細胞は従来困難とされた病気の治療に新しい道を開きつつあります。具体的な応用例を見てみましょう。
再生医療分野に応用できる(心筋シート・網膜・脊髄)
iPS細胞は、その多能性を活かして多様な組織や臓器の再生につながる研究が世界中で進められています。とりわけ注目されているのが心臓疾患への応用です。心筋梗塞や心不全でダメージを受けた心臓は自然には回復しにくく、従来の治療では根本的な改善は難しいとされてきました。
しかし、iPS細胞から作られた心筋シートを心臓の表面に移植する研究では、心筋の収縮機能を取り戻し、血流を改善できる可能性が示されています。実際に日本でも臨床研究が進み、重症心不全患者を対象にした試験が国際的にも注目を集めています。
さらに、神経系疾患への応用も大きな期待を集めています。脊髄損傷では、損なわれた神経がつながることは従来困難とされてきましたが、iPS細胞から分化させた神経前駆細胞を移植することで、感覚や運動機能の一部回復を目指す臨床研究が進行しています。パーキンソン病においても、iPS細胞からドーパミンを分泌する神経細胞を作り出して移植する試みが行われており、症状の改善例が報告されています。
また、眼科領域でも先駆的な研究が進んでいます。加齢黄斑変性という視力を失う難病に対し、iPS細胞由来の網膜色素上皮細胞を移植する臨床試験が行われ、世界初の成功例も生まれました。これにより、視覚再生の新たな可能性が具体的に見えてきています。
創薬・疾患モデルに活用できる
iPS細胞の魅力は再生医療だけにとどまりません。大きなインパクトを持つのが「創薬」と「疾患モデル」の活用です。従来、新薬の開発では動物実験や培養細胞を利用して安全性や効果を確認してきました。
しかし動物と人間では反応が異なる場合が多く、副作用や有効性の予測に限界がありました。そこで注目されているのが、患者自身の体細胞から作ったiPS細胞です。これを用いると、実際の患者と同じ遺伝的背景を持つ細胞を研究に使えるため、動物実験では見えなかった病気特有の仕組みを再現できるのです。
例えば、ALS(筋萎縮性側索硬化症)やパーキンソン病といった難病の神経細胞をiPS細胞で作り、病態を“再現”することで原因を探る研究が進んでいます。さらに、創薬開発ではこれらの細胞を使って「副作用予測モデル」を構築する試みも始まっており、新薬の開発効率を飛躍的に高める可能性があります。心臓細胞や肝臓細胞をiPS細胞から分化させ、薬剤の安全性を事前に確認する研究も報告されています。
将来的にはiPS細胞から得られる疾患モデルを通じて「より安全で効果的な薬」を迅速に届けることができ、現代医療の革新的な基盤となることが期待されています。
iPS細胞の実用化の進捗と課題
iPS細胞は、2006年に京都大学の山中伸弥教授らによって開発されて以来、再生医療や創薬の分野で「夢の技術」として期待を集めてきました。
すでに国内外で臨床応用が進みつつありますが、同時に安全性・コスト・倫理など数多くの課題も浮き彫りになっています。
ここでは、iPS細胞の最新の進捗と課題について整理します。
臨床応用の進展
iPS細胞は、再生医療の分野で臨床応用が段階的に進んでいます。日本では京都大学iPS細胞研究所(CiRA)を中心に、心筋シートを用いた重症心不全治療や、網膜細胞移植による加齢黄斑変性の改善などの臨床試験が行われています。
さらに、脊髄損傷、パーキンソン病、角膜疾患などへの応用研究も進行中で、これまで治療法が限られていた病気に対して新たな可能性を切り開いています。将来的には、難治性疾患の治療オプションとして一般化することが期待されています。
安全性が問われている
iPS細胞の実用化において最も重要な課題のひとつは安全性の確保です。iPS細胞には「がん化リスク」が潜在しており、移植後に腫瘍が発生しないかどうかを徹底的に検証する必要があります。また、培養や分化の過程で細胞の品質にばらつきが生じやすいため、安定的に高品質の細胞を供給する仕組みづくりが欠かせません。
中でも大規模臨床での使用を想定すると、研究室レベルでの成功だけでは不十分で、医療現場に適した製造・管理プロセスが必要となります。
iPS細胞を患者ごとに作成するには膨大なコストがかかる
iPS細胞を患者ごとに個別作製するには、膨大な時間とコストがかかります。そのため、社会全体で普及させるには「iPS細胞ストック」構想が不可欠です。これは、あらかじめ多様な遺伝的背景を持つ細胞を保存しておき、必要に応じて適合する患者に提供する仕組みです。ストックによって費用を大幅に削減できますが、依然として培養コストは高く、普及には課題が残ります。
また、コストだけでなく、医療保険制度や倫理的な合意形成など、社会的な仕組みも整備されなければなりません。
倫理的な課題がある
iPS細胞は、ES細胞と違って受精卵を必要としないため倫理的に優れていますが、それでも新たな倫理問題が存在します。たとえば、ヒトと動物の細胞を組み合わせる「キメラ研究」や、生殖細胞を作り出す研究などは国際的にも強い規制が課されています。
科学的な可能性を広げる一方で、社会的な受容性や倫理観との調和をどう図るかは大きな課題です。研究の自由と倫理的制約のバランスを慎重に検討することが、今後の実用化の前提条件となります。
医療現場で活用するための国際的なルールが必要
iPS細胞を医療現場で実際に使うためには、厚生労働省などの規制当局から厳格な承認を得る必要があります。そのため、学術界・企業・規制機関が連携し、国際基準を踏まえたルールづくりを進めることが不可欠です。
日本国内では、大阪・関西万博における展示や実証実験などを通じて国際的な情報発信も行われています。今後は海外の研究機関や製薬企業とも協力しながら、国際的に共通する枠組みの整備を進めることが、グローバルな普及への鍵になると考えられます。
大阪・関西万博で注目のiPS細胞展示と未来展望
大阪・関西万博では、iPS細胞研究の成果が一般公開されます。未来の医療を体感できる展示内容を見ていきましょう。
万博で展示されるiPS細胞関連技術
2025年の大阪・関西万博では、「いのち輝く未来社会のデザイン」をテーマに、iPS細胞を活用した最新の再生医療研究が展示される予定です。特に注目されているのが、京都大学iPS細胞研究所(CiRA)をはじめとする研究機関が開発した心筋シートや網膜再生技術など、現在進行中の臨床研究が一般にわかりやすく紹介される点です。展示では、細胞培養の仕組みや、再生医療が実際にどのように患者治療へ応用されるのかを理解できる体験型ブースが設けられる予定で、来場者は「科学と医療の未来」に直接触れられます。
このiPS細胞展示の社会的意義は、単なる技術紹介にとどまりません。第一に、研究の進捗や課題を広く市民に伝えることで、再生医療に対する正しい理解と社会的合意形成を促す役割があります。第二に、未来の医療技術を実際に体感できることで、健康や生命倫理に関する意識を高める教育効果も期待されます。
さらに、国際的な来場者が多い万博において、日本発の先端研究を発信することは、iPS細胞研究における日本のリーダーシップを世界に示す絶好の機会となります。こうした展示を通じて、iPS細胞が人々の暮らしにどう関わるのか、その未来像を具体的に描き出すことができるのです。
来場者に伝える再生医療の可能性
大阪・関西万博で予定されているiPS細胞関連の展示は、単なる最新研究の紹介にとどまらず、来場者に「再生医療とは何か」「未来の医療はどう変わるのか」を直感的に理解させる機会となります。心筋シートや網膜再生といった臨床研究の成果が目に見える形で紹介されることで、研究室の中にある専門的な知識が社会全体に開かれるのです。このような展示を通して、一般来場者は「失われた臓器や機能が回復する未来」を想像しやすくなり、医療への期待と理解を深められます。
さらに万博が持つ大きな役割は、科学教育と啓発の場としての機能です。学校教育では触れる機会が少ない最先端医療を身近に体感できるため、子どもから大人まで幅広い世代に科学的リテラシーを育む効果が期待されます。
加えて、生命倫理や安全性といったテーマについて考えるきっかけも提供し、社会が新技術とどう向き合うかについての議論を促します。国際的な参加者が集まる万博でiPS細胞の成果を共有することは、日本が再生医療研究の先進国であることを世界に発信すると同時に、未来の医療を「市民とともに形づくる場」として大きな意義を持っています。
iPS細胞と「心臓再生」プロジェクト
iPS細胞を用いた心臓再生プロジェクトは、心不全や虚血性心疾患といった治療困難な病気に対する新たな希望とされています。現在、日本を中心に心筋シートの臨床研究が進行中です。これはiPS細胞から作った心筋細胞をシート状にして心臓へ移植し、機能を失った部分を補うものです。
実際に重症心不全患者を対象にした試験では、安全性と心機能の一部改善が報告されつつあります。今後は、移植細胞の長期生着や不整脈リスクなど課題を克服する必要がありますが、将来的には虚血性心疾患や拡張型心筋症を含め、心臓病治療の選択肢を大きく広げることが期待されています。
iPS細胞研究の倫理的課題と社会的責任
iPS細胞は医療の可能性を広げる一方で、倫理や社会的な課題も抱えています。代表的な論点を整理して見てみましょう。
倫理的問題と国際ルール
iPS細胞は、ES細胞のように受精卵を直接使用しないため倫理的なハードルを下げた画期的技術ですが、それでも新たな課題は残されています。例えば、胚の使用については、生殖医療や研究と密接に関わるため「どこまで許容するか」という国際的な議論があります。また、iPS細胞を用いてヒトと動物の細胞を融合・移植する研究、いわゆるキメラ研究も進んでいますが、「人間らしい性質」が動物に備わる懸念から強い倫理規制が設けられています。
さらに、遺伝子編集技術(CRISPR/Cas9など)とiPS細胞を組み合わせることで、病気の原因遺伝子を正確に修復する可能性もある一方、デザイナーベビー問題のように倫理的境界を越える危険性も指摘されています。こうした課題を踏まえ、各国では研究範囲を制限する国際ルールやガイドラインを整備しており、安全性と社会的合意のバランスをとりながら研究を推進することが求められています。
がん化リスクと安全性試験
iPS細胞の臨床応用で最も懸念されているのが、移植した細胞が腫瘍化(がん化)するリスクです。iPS細胞は強い「自己複製能」と「多能性」を持つため、十分に分化させないまま体内へ移植すると、腫瘍を形成してしまう可能性があります。これを防ぐため、研究者は完全に分化誘導した細胞のみを使用する技術や、未分化細胞を検出する高感度検査を開発し、安全性を高めています。
また、移植後の免疫拒絶反応も課題のひとつです。これに対しては、患者本人の細胞からiPS細胞を作製する「自家移植」の他、多数の遺伝的背景をカバーするiPS細胞ストックを整備し、適合率を高める取り組みが進められています。さらに、免疫抑制剤の使用や遺伝子編集を組み合わせ、安全性と持続性を両立する方法も研究中です。
こうした多層的な安全性試験とリスク回避策によって、実用化への信頼性が少しずつ高まっています。
社会がiPS技術とどう向き合うか
iPS細胞は再生医療から創薬まで医療の未来を大きく変える力を持っていますが、その可能性を社会でどう受け止め、運用していくかが重要です。まず課題となるのは実用化へのスピードと慎重さのバランスです。患者に一刻も早く届けたい一方で、安全性や倫理的議論を軽視すれば社会的不信を招きかねません。したがって、臨床現場に応用する際には、国際基準に基づいた規制や試験を徹底する必要があります。
また、政策の役割も大きいです。公的な研究資金の投入だけでなく、保険適用の範囲やiPS細胞ストックの整備など、制度面での後押しが普及のカギを握ります。同時に、教育や啓発活動によって、専門知識を持たない一般市民にも分かりやすく伝えることが不可欠です。学校教育や科学イベントでの情報発信を通じて、生命倫理や科学リテラシーを高めることが、社会全体での合意形成につながります。科学者だけでなく行政、教育、そして市民すべてが参加する「開かれた議論の場」が求められているのです。
日本のiPS細胞研究体制と国際連携
日本はiPS細胞研究の先駆けとして世界をリードしてきました。その体制や国際的な連携の取り組みを具体的に見ていきましょう。
京都大学iPS細胞研究所(CiRA)の役割
京都大学iPS細胞研究所(CiRA)は、日本のiPS細胞研究の中心拠点として世界的に評価されています。設立以来、山中伸弥教授をはじめとする研究者が、基礎研究から臨床応用まで幅広い分野をリードしてきました。特に、iPS細胞の分化・培養技術の標準化、そして「iPS細胞ストックプロジェクト」の推進は、国内外の臨床研究を加速させる大きな原動力となっています。これにより、患者ごとに個別に細胞を作らずとも、多くの人に適合するiPS細胞を提供する仕組みが整備されつつあります。
さらに、CiRAは再生医療のみならず、創薬や疾患モデル研究でも重要な役割を果たしています。製薬企業や研究機関との連携を通じ、治療法だけでなく新薬の開発スピードや安全性評価の向上にも貢献しています。また、社会的責任として「倫理面」にも力を入れ、国際ルールに則った指針づくりや市民への情報発信を行い、透明性の高い研究体制を維持しています。こうした取り組みは、日本のiPS研究を世界にアピールするだけでなく、国際協力の基盤としても大きな意味を持っているのです。
理化学研究所・CiRA財団の連携
日本のiPS細胞研究体制を支える重要な柱の一つが、理化学研究所とCiRA財団の連携です。両者は役割分担を明確にしながら、研究から実用化までを一気通貫で支える仕組みを構築しています。まず、CiRA財団は「iPS細胞ストックプロジェクト」を担い、国内外のドナーから細胞を提供してもらい、臨床応用に適したiPS細胞を製造・提供しています。この細胞は厳格な品質評価を経て、安定した研究・治療の基盤となっています。
一方、理化学研究所は基礎科学と先端技術の開発を主導し、iPS細胞の品質評価技術や新しい分化誘導法の確立に取り組んでいます。この役割分担により、大学や医療機関は研究の信頼性を高めながら臨床応用に進めることが可能となっています。
さらに両者は製薬企業やバイオテック企業と連携し、産業界への支援体制を構築。iPS細胞を使った創薬や再生医療の事業化を推進することで、日本発の技術を国内外に広げています。このように理研とCiRA財団の緊密な連携は、研究成果を迅速かつ安全に社会へ還元するための中核的な仕組みとして機能しています。
海外研究機関との比較・連携
iPS細胞研究は日本が先駆者として知られていますが、海外の研究機関も急速に追随し、独自の強みを発揮しています。米国ではハーバード大学やスタンフォード大学を中心に、創薬応用やビッグファーマとの提携が進み、治験へのスピード感で優位に立っています。中国は国家規模の投資を背景に、臨床試験数を急速に拡大させており、実用化を前倒しする大胆さが特徴です。ヨーロッパはEUの規制のもと、安全性・倫理性を重視しながら、長期的な医療体制への組み込みを進めています。
これに対し、日本の強みは高品質な細胞提供と厳格な品質評価です。CiRA財団のiPS細胞ストック事業では、HLA型の異なる多様な細胞を用意し、国際的にも希少な「臨床レベルで利用可能な細胞バンク」として世界に供給しています。また、理化学研究所がリードする品質評価の仕組みは、海外研究機関からも信頼を集めています。
さらに産業界との連携を視野に、海外企業への技術移転や共同研究も積極的に推進。日本は研究の質と倫理性でリーダーシップを発揮しつつ、米中のスピードと競合しながら持続可能な国際連携体制を築こうとしています。
iPS細胞とSDGs:誰もが健康であるために
iPS細胞は最先端医療としてだけでなく、持続可能な開発目標(SDGs)の実現にも直結します。その具体的な関連を見ていきましょう。
SDGs目標3との関連:「再生医療」で病気を治す
国連が掲げるSDGs目標3「すべての人に健康と福祉を」には、感染症や難病、生活習慣病などあらゆる疾病に対して公平な医療を届けるという重要な視点が含まれています。iPS細胞はこの目標に直結する技術です。心不全や脊髄損傷、加齢黄斑変性といった従来は治療不可能と考えられていた疾患に対し、再生医療を通じて「失った機能を回復させる」可能性を切り拓いています。
また、患者の細胞から作製することで個別化医療を実現し、副作用の少ない治療法開発にもつながります。さらに、iPS細胞を用いた疾患モデルは新薬開発の効率化にも貢献し、より低コストで安全な薬を世界中に届ける助けとなります。
つまり、iPS細胞は「誰一人取り残さない医療」を実現するための中核技術であり、SDGs目標3の達成を加速する大きな推進力となっているのです。
SDGs目標9との関連:バイオテクノロジーの産業化
SDGs目標9「産業と技術革新の基盤をつくろう」は、科学技術を社会や産業に実装することを重視しています。iPS細胞はまさにその核心にあり、日本発の革新技術としてバイオ産業の競争力強化に直結しています。日本は京都大学CiRAの研究を起点に、再生医療、創薬支援、細胞ストック事業といった多様な分野で産業化が進んでいます。特に「iPS細胞バンク」や「心筋シートの商用開発」などは実用化に近く、国内外の製薬企業やベンチャーとの連携で市場拡大が期待されています。
国際的には、アメリカや中国も活発にiPS研究を産業化しており、臨床試験数や投資規模で日本に迫る勢いがあります。その中で日本の強みは「基礎研究の質」と「臨床への慎重で確実なアプローチ」、さらに政府による制度的支援にあります。今後は国際連携と知財戦略の強化が不可欠であり、世界市場での優位性をどう維持するかが課題です。
iPS細胞産業を発展させることは、医療だけでなく製薬、バイオ分野を含む幅広い産業基盤を底上げし、SDGs目標9の実現に大きく貢献すると言えます。
iPS細胞に関するよくある質問
iPS細胞は注目を集める一方で、多くの疑問もあります。ここではよくある質問に分かりやすく答えていきます。
iPS細胞とは何ですか?ES細胞との違いも含めて簡単に教えてください。
iPS細胞(人工多能性幹細胞)は、皮膚や血液などの体細胞に特定の遺伝子を導入し、胚のような未分化状態に初期化した細胞です。心臓や神経など様々な細胞へ分化でき、再生医療や創薬研究に活用されています。
ES細胞(胚性幹細胞)は受精卵から得られるため倫理的課題がありますが、iPS細胞は体細胞由来であり倫理的な制約を回避できる点が大きな違いです。
iPS細胞を使った再生医療は、現時点でどんな病気の治療に使われていますか?
現在、iPS細胞を利用した再生医療は臨床研究や治験段階にあります。代表的な例として、心不全患者に対する心筋シート移植や、加齢黄斑変性に対する網膜再生治療、脊髄損傷に対する神経細胞移植があります。
これらは従来治療困難だった病気に対し、機能回復を目指すもので、実際に患者への臨床応用が進められており、今後の普及が期待されています。
iPS細胞の安全性はどのように確保されていますか?
iPS細胞は強い「増殖力」と「多能性」を持つため、分化が不十分な細胞が残ると腫瘍化のリスクがあります。これを防ぐため、移植前には未分化細胞を徹底的に除去する技術や、高感度検査での安全確認が行われています。
また、品質基準を満たす細胞のみを用いる「iPS細胞ストック」の活用や、免疫拒絶を最小限に抑える仕組みの導入により、安全性を確保する体制が整えられています。
大阪・関西万博で展示されるiPS細胞の研究は、一般人にどのような学びにつながりますか?
大阪・関西万博で展示されるiPS細胞の研究は、来場者に最先端医療を「見て・触れて・理解する」機会を提供します。例えば心筋シートや網膜再生の仕組みを分かりやすく紹介することで、iPS細胞が未来医療にどう活かされるかを実感できます。
また、医療の進歩と同時に、倫理や安全性への配慮が必要であることも伝えられ、科学教育や生命倫理の理解を深めるきっかけにもなります。
将来的にiPS細胞を使った治療は保険適用されるのでしょうか?費用面はどうなりそうですか?
iPS細胞を使った治療の一部は既に臨床研究段階に進んでおり、安全性と有効性が確認されれば将来的に保険適用の対象となる可能性があります。ただし、細胞の製造や管理には高いコストがかかり、現段階では数百万円以上かかるケースもあります。
これを解決するために「iPS細胞ストック」の整備や製造技術の効率化が進められており、量産体制が整えば費用は大きく下がり、保険診療として一般的に利用できる日が来ると期待されています。
まとめ
iPS細胞とは体細胞を初期化して多能性を持たせた細胞で、心筋シートや網膜再生など再生医療の臨床応用が進んでいます。
一方で、がん化リスクや高コストといった課題も存在し、品質管理やiPS細胞ストック整備が進められています。大阪・関西万博での展示は、科学教育や社会的合意形成の機会となり、日本の国際競争力強化やSDGs達成にも貢献すると期待されています。
 NEXT WELLNESS
NEXT WELLNESS 
